Atomun Kuantum Modeli
KUANTUM SAYILARI :
Kuantum sayıları orbitallerin ve orbitallerde yer alan elektronların belirlenmesinde kullanılır.
Baş (Birincil) Kuantum Sayısı (n):
Elektronun enerji düzeyine ve elektronun çekirdeğe olan ortalama uzaklığına bağlı olarak değişen kuantum sayısına denir ve n ile gösterilir. Pozitif tam sayı değerlerini alır. Enerji düzeyleri kabuk olarak da adlandırılır. Harflerle (n=K, L, M, N…) ya da sayılarla (n=1, 2, 3, 4…) ifade edilir.

Açısal Momentum (İkincil, Yan) Kuantum Sayısı (ℓ):
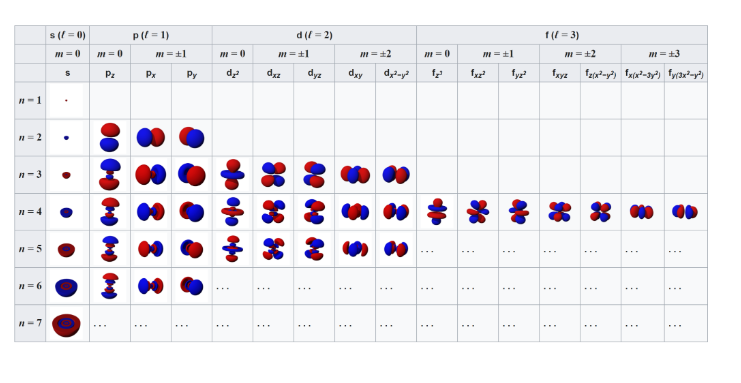
Orbitalin şeklini ve bir enerji düzeyinde kaç tane alt enerji düzeyi olduğunu veren kuantum sayısına denir ve ℓ ile gösterilir. Açısal momentum kuantum sayısı, enerji düzeylerinin de alt enerji düzeyine ayrıldıklarını gösterir. ℓ sıfırdan n-1’e kadar olan tüm değerleri alır. ℓ=0, 1, 2, …, (n-1) Açısal momentum kuantum sayısının herbir değeri bir orbital türüne karşılık gelir. Herbir enerji düzeyindeki açısal momentum kuantum sayısı kadar alt enerji düzeyi bulunur.

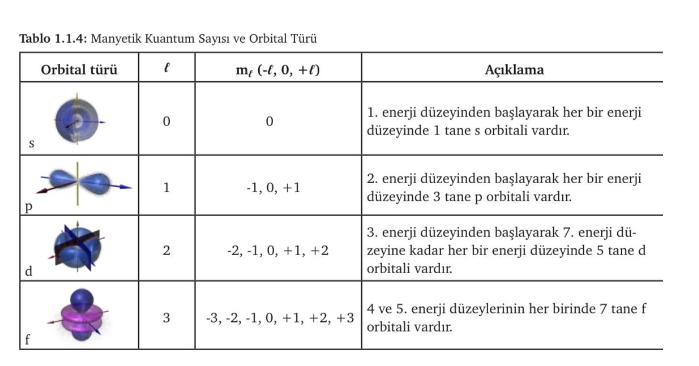
Manyetik Kuantum Sayısı (mℓ):
Orbitaller farklı şekillerde bulunur ve manyetik alanda s orbitali hariç çeşitli yönelişlere sahiptir. Alt enerji düzeyinde kaç tane orbital olduğunu gösteren kuantum sayısına denir ve mℓ ile gösterilir. mℓ sıfır da dâhil olmak üzere –ℓ ile +ℓ arasındaki bütün tam sayı değerlerini alabilir.
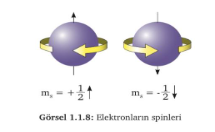
Spin Kuantum Sayısı (ms):
Elektronun kendi ekseni etrafında dönme hareketi spin olarak adlandırılır ve elektron 2 spine sahiptir. Elektronun, saat yönünde ve tersi yönde hareketi ile belirli bir hızda döndüğü düşünülebilir. Bu durum spin kuantum sayısı ile ifade edilir ve ms ile gösterilir.
KAYNAKLAR
11. Sınıf MEB Kitabı
https://bikifi.com/biki/atomun-kuantum-modeli/
https://evrimagaci.org/1s2-2s2-2p6-3s2-3p6-elektronlar-atomun-etrafinda-nerede-bulunuyor-elektron-konfigurasyonlari-ne-anlama-geliyor-9394
https://www.youtube.com/watch?v=2ww9Au6_RFM























